Радиочастотная катетерная абляция (РЧА) сердца.
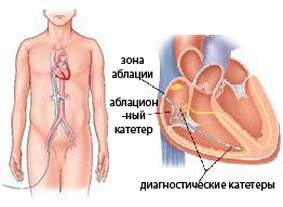
РЧА сердца – хирургическое катетерное вмешательство, с использованием специальных катетеров, пукнционно введенных в полость сердца через сосуды, и радиочастотной энергии, направленное на устранение нарушений сердечного ритма (аритмии).
Радиочастотная абляция – один из самых современных методов лечения некоторых видов нарушений ритма сердца. Этот вид лечения относится к малоивазивным вмешательствам, так как для его проведения не требуется никаких разрезов и доступов к сердцу, но иногда РЧА выполняется при операциях на открытом сердце. Радиочастотная абляция проводится с помощью тонкого гибкого катерера-проводника, который вводится через кровеносный сосуд и подводится к источнику патологического ритма в сердце, вызывающего аритмию. Далее по этому проводнику подается радиочастотный импульс, который разрушает участок ткани, отвечающий за неправильный ритм.
Впервые высокочастотную энергию для устранения дополнительных АВ-путей проведения, применяемую и по сей день, произвели в 1986 году М.Borggrefe и соавт. С этого времени и началось бурное развитие интервенционной аритмологии в лечении аритмий сердца.
Существует два варианта подачи электрической энергии: монополярный и биполярный. При монополярной аблации переменный ток проходит между дистальным концом “активного” электрода через ткани к “пассивному” электроду на поверхности грудной стенки. Обычно “пассивным” или референтным электродом служит пластина. Эксперименты показали, что позиция пластины незначительно влияет на размер воздействия, в то время как увеличение ее площади ведет к отклонению импеданса и приводит к увеличению энергии и перегреву электрода. В случае биполярной коагуляции ток проходит между двумя активными электродами в полостях сердца.
Ведущим механизмом коагуляции тканей под воздействие радиочастотного тока является превращение электрической энергии в тепловую. Если плотность тока высокая, а электропроводность низка, то это приводит к возбуждению ионов, которые начинают следовать изменениям направления переменного тока. Оба этих фактора имеют место в ткани окружающей «активный» электрод. Это возбуждение ионов ведет к образованию фрикционной теплоты так, что ткань прилегающая к электроду, а не сам электрод, является главным источником теплоты. Повышение температуры в миокардиальной ткани приводит к некоторым электрофизиологическим эффектам. На изолированных папиллярных мышцах свиных сердец было отмечено, что при температуре ткани 38-45°С в течение 1 минуты происходит повышение функции K-Na каналов клеток вплоть до критического уровня. Нагревание до 45-50°С ведет за собой инактивацию этих структур. Анормальный автоматизм клеток отмечен при повышение температуры свыше 45°С, повышенная возбудимость свыше 50°С. Биологическая смерть клеток зависит от двух факторов – времени воздействия и температуры. Обратимые клеточные изменения происходят при длительном нагревании даже при температуре ниже 45°С, в то время, как необратимая смерть клеток вероятно происходит между 52°С и 55°С. Денатурация внутреннего слоя протеинов мембран клеток играющего важнейшую роль в транспортных обменных процессах является важнейшим механизмом терминальной клеточной смерти. При температуре выше 100°С происходит испарение клеточной жидкости и повреждение клеточной мембраны миоцита, саркоплазматического ретикулума и митохондрий. Если температура превышает 140°С, может произойти карбонизация ткани. В этой связи с целью обеспечения более мягкой коагуляции тканей следует поддерживать температуру тканей на уровне ниже 100°С. Температуру ткани, находящейся в контакте с электродом, можно контролировать специальным катетером для аблации со встроенными в конец катетера термисторами или термопарами. Непосредственно разогревания электрода электрическим током не происходит вследствие его хорошей электропроводности.
Прогрессивное воздействие достигается благодаря созданным устройствам контроля температуры высокочастотной энергии (Haverkampf et al. 1991). Контроль температуры означает, что температура на конце катетера не только изменяется в течение процесса коагуляции, но и поддерживается на определенном уровне благодаря механизму обратной связи для подаваемой мощности. Такое устройство позволяет создавать ограниченное поражение с предсказуемой степенью in vitro и обеспечивает хороший контакт между электродом, вызывающим аблацию, и миокардом. Мониторинг температуры становится практически сложным при увеличении размера электрода или его геометрии. Так, например, для линейной аблации ФП и ТП используются удлиненные электроды, имеющие одну термопару, таким образом невозможно предсказать какой стороной происходит контакт поверхности электрода с эндокардом и температура краевой повехности может оказаться намного выше, чем тела электрода, где расположен термодатчик. Таким образом, температура в серединной точке остается недооцененной.
В некоторых экспериментальных исследованиях продемонстрирован трехмерный окончательный элементарный анализ влияния геометрии электрода, угла наклона контакта электрод-ткань и циркуляции окружающей крови на размер аблационного повреждения.
Длительность радиочастотной аблации так же является важным критерием, влияющим на трансмуральность воздействия. Наибольшее увеличение размера повреждения происходит в течение первых 30 секунд аблации, а затем наступает плато.
Некоторое усовершенствование аблации было достигнуто в результате использования электрода с охлаждением наконечника инфузией физиологического раствора. Такая конструкция позволяет использовать высокие цифры энергии воздействия, увеличивая размер повреждения, но избегая при этом высоких цифр импеданса. Эта концепция была подтверждена в экспериментах in vivo и in vitro. Охлаждение в течение аблации приводит к повышению температуры глубже поверхности эндокарда. Максимальная температура регистрируется на глубине 1 мм и более от поверхности эндокарда, таким образом даже выше, чем в области контакта электрода с поверхностью эндокарда. Катетеры для холодовой аблации могут быть закрытого типа, когда охлаждающий раствор циркулирует внутри системы и открытого типа, имеющие маленькие дырочки через которые происходит орошение электрода и жидкость вытекает наружу.
Таким образом, радиочастотная аблация является безопасной и эффективной методикой. В ходе проведения экспериментальных исследований не отмечено возникновения таких серьезных осложнений, как аритмии, расстройства гемодинамики, ишемия, тромбоз или эмболия. Наибольшую опасность представляет собой перегревание и последующее повреждение аблационного катетера и выпаривание ткани. С целью ограничения риска этих осложнений многие исследователи считают необходимым проводить измерение биофизических параметров (сила тока, напряжение, температура) на конце катетера.
Относительными противопоказаниями к проведению РЧА являются: нестабильная стенокардия; неконтролируемая сердечная недостаточность; нарушения системы свертывания крови; выраженные электролитные нарушения, стеноз ствола левой коронарной артерии более 75%, высокая степень клапанного или подклапанного стеноза аортального клапана (при необходимости вхождения в полость ЛЖ), первые 4 дня острого инфаркта миокарда. Пункция и проведение катетеров противопоказаны через бедренные сосуды при тромбофлебите, инфекции и двусторонней ампутации конечностей.
Возможные осложнения РЧА сердца
Осложнения при проведении эндо-ЭФИ и РЧА можно разделить на 4 группы:
1. осложнения, обусловленные лучевой нагрузкой (примерно 1 миллизиверт);
2. осложнения, связанные с пункцией и катетеризацией сосудов (повреждение артерий, тромбофлебит, артериовенозная фистула, пневмоторакс);
3. осложнения при катетерных манипуляциях (повреждение клапанов сердца, эмболия – системная или в легочную артерию, перфорация коронарного синуса или стенки миокарда, перфорация сердца, тампонада, инфекция – системная или в месте пункции);
4. осложнения, обусловленные радиочастотным воздействием (артериовентрикулярная блокада, миокарда).
Данная операция относится к классу малоинвазивных вмешательств. Преимущества же такого хирургического вмешательства очевидны: минимальная травматичность, как правило, отсутствие необходимости в назначении общей анестезии, небольшая продолжительность операции, короткий послеоперационной койко-день.
Как подготовиться к РЧА.
РЧА проводится в плановом порядке. Операция проводится в рентген-операционной. Общие принципы подготовки к операции включают в себя:
• Последний прием пищи вечером накануне опреации (12 ч голода).
• В месте установки катетера (паховая и подключичная область) должны быть выбриты волосы.
• В ночь перед исследование проводиться очищение кишечника.
• Спросите своего врача, следует ли вам принимать обычные лекарства утром.
• Все антиаритмические препараты отменяются за 2–3 дня до исследования (пять периодов полувыведения), для кордарона это 28 дней.
• Если у вас сахарный диабет, спросите своего врача, следует ли Вам принимать инсулин или другие сахароснижающие пероральные препараты перед исследованием.
Методика проведения РЧА сердца.
РЧА сердца проводится в специально оборудованной операционной, оснащенной:
• рентгенотелевизионной системой для рентгеноскопии и/или рентгенографии;
• оборудованием для слежения за жизненно важными функциями организма и проведения реанимационных мероприятий (дефибриллятор, дыхательный аппарат, мониторы);
• специализированным ЭФИ-оборудованием для записи поверхностных электрокардиограмм и внутрисердечных электрограмм и снабженным
• специализированным электрокардиостимулятором и набором инструментов для проведения катетеризации сердца и электродов-катетеров для проведения ЭФИ и РЧА;
• защитным оборудованием для пациента и персонала (костюмы, фартуки, очки, передвижные стенки и т. д.).
Пациент для проведения операции РЧА поступает в операционную натощак, в слегка седатированном состоянии. Области предполагаемых пункций сосудов тщательно обрабатываются и накрываются стерильным бельем. Проведение катетеров всегда производится с использованием чрескожной техники. Для пункции используются обычно бедренные вены справа и/или слева, подключичная вена слева и/или справа и югулярная вена справа, а также вены предплечья. Для артериального доступа обычно используется правая бедренная артерия, однако возможна пункция бедренной артерии слева и лучевых артерий.
Местная анестезия места пункции, после этого производится пункция вены с помощью иглы, которая вводится в сосуд, и проводится необходимой длины проводник, после чего игла вытаскивается. Далее по проводнику вводится интродьюсер, а затем электрод-катетер в соответствующую камеру сердца. Разместив катетеры в различных камерах сердца, их подключают к соединительной коробке, которая переносит электрические сигналы от электродов в сердце к записывающему оборудованию и позволяет стимулирующему импульсу от ЭКС достигать поверхности различных камер сердца. Выполняется ЭФИ сердца. Электрические сигналы, полученные от эндокардиальной поверхности сердца, фильтруются, усиливаются и выводятся на мониторе компьютера. Программируемый ЭКС должен обладать способностью для постоянной и программируемой стимуляции, подачи множества экстрастимулов (до 7), регулировки амплитуды и длительности импульса, а также возможностью воспринимать внешние и внутрисердечные сигналы.
При проведении ЭФИ пациент может ощущать дискомфорт в грудной клетке, сердцебиения, небольшую болезненность. Ощущения, возникающие при проведения ЭФИ, в виде перебоев сердца, секундных остановок, ускорения или замедления ритма являются результатом работы врача, т.е с помощью электрических импульсов, подаваемых непосредственно в сердце, врач полностью контролирует сердцебиение, провоцируя приступ сердцебиения или прекращая его во время поиска аритмогенных участков. При обнаружении аритмогенных зон (дополнительных предсердно-желудочковых соединений, эктопической активности и т. п.) на нее воздействуют радиочастотной энергией с помощью «лечебного» электрода. После чего в обязательном порядке (примерно через 20 минут) проводят еще раз ЭФИ для оценки эффективности воздействия. Если электрофизиологические показатели удовлетворяют врача, то операцию заканчивают. Удаляют катетеры. На места пункций накладывают гемостатические (давящие) повязки.
Вас переводят в отделение и назначают постельный режим в положении на спине на несколько часов (в некоторых случаях до суток) с целью предупреждение кровотечения из места пункции. Наблюдение в стационаре от одного дня.
Источник:
Ревишвили А.Ш. «Клиническая кардиология: диагностика и лечение», 2011 под редакцией Бокерия Л.А., Голуховой Е.З.